obliczenia molowe
Monika: Bardzo bardzo mocno potrzebuje rozwiązania tych zadań. Błagam osobę, która potrafi to ogarnąć o
rozwiązanie. Potrzebuję to na poniedziałek. Bardzo proszę o pomoc.
1. Do 240 g wody dodano 60g azotanu (V) amonu. Oblicz stężenie NH4NO3 w tym roztworze.
2. Jaką masę siarczanu (VI) sodu należy rozpuścić w 850g wody, aby uzyskać 15% roztwór tej
soli?
3. Jaką masę wody należy odważyć, aby przygotować 400 g roztworu chlorku sodu o stężeniu 8,0%?
4. Do 250 cm3 alkoholu metylowego dodano 50 cm3 gliceryny. Oblicz stężenie procentowe gliceryny
w alkoholu metylowym. Gęstość alkoholu metylowego − 0,792g/cm3, gliceryny − 1,261g/cm3
5. Pewien gatunek mosiądzu zawiera: 80,0% Cu, 16,0% Zn, 2,5% Si, a resztę stanowią
zanieczyszczenia. Oblicz masę krzemu oraz masę zanieczyszczeń w 850 kg tego stopu.
6. W 450 cm3 roztworu znajduje się 0,900 mola HCl. Oblicz stężenie molowe kwasu solnego w tym
roztworze.
7. W wodzie rozpuszczono 2,5 mola NaOH, uzyskując roztwór o stężeniu 0,500 mol/dm3. Oblicz
objętość uzyskanego roztworu.
8. Jaką masę azotanu (V) sodu należy rozpuścić w wodzie, aby uzyskać 500 cm3 roztworu o
stężeniu 0,300mol/dm3?
9. Jakie jest stężenie molowe roztworu kwasu siarkowego (VI), jeżeli w 350 cm3 tego roztworu
znajduje się 68,6g H2SO4?
10. W 150 g wody rozpuszczono pewną ilość siarczanu (VI) sodu otrzymując roztwór o stężeniu
1,026 mol/dm3 i gęstości 1,121 g/cm3. Oblicz masę rozpuszczonego NaSO4.
11. Rozpuszczono w wodzie 2,81 mola amoniaku, uzyskując 500 cm3 roztworu o gęstości 0,958g/cm3.
Oblicz stężenie procentowe amoniaku w tym roztworze.
12. Jaka liczba moli H3PO4 znajduje się w 600 cm3 65,0% roztworu kwasu fosforowego (V) o
gęstości 1,475g/cm3?
13. Oblicz stężenie molowe 30,0% roztworu wodorotlenku potasu o gęstości 1,291g/cm3.
14. Oblicz stężenie procentowe roztworu wodorotlenku sodu o stężeniu 9,96 mol.dm3 i gęstości
1,328g/cm3.
15. Ile gramów wody należy dodać do 100g 30,0% roztworu nadtlenku wodoru, aby uzyskać 3,0%
roztwór?
16. W jakim stosunku objętościowym należy zmieszać 36,0% kwas solny i wodę, aby uzyskać 15,0%
roztwór tego kwasu?
17. W jakim stosunku objętościowym należy zmieszać 30,0% kwas azotowy (V) i wodę, aby uzyskać
12,0% roztwór tego kwasu. Gęstość 30,0% roztworu HNO3 wynosi 1,180g/cm3.
18. Zmieszano 200 cm3 20,0% roztworu kwasu octowego o gęstości 1,026 g/cm3 oraz 550 cm3
roztworu tego kwasu o stężeniu 6,99 mol/dm3 i gęstości 1,049 g/cm3. Oblicz stężenie procentowe
otrzymanego roztworu.
19. W jakim stosunku masowym należy zmieszać roztwory formaldehydu 8,0% oraz 20,0%, aby uzyskać
15,0% roztwór tej substancji?
20. W jakim stosunku objętościowym należy zmieszać 15,0% roztwór kwasu mrówkowego i 40,0%
roztwór tego kwasu, aby uzyskać roztwór o stężeniu 25,0%? Gęstość roztworów: 15,0% − 1,037
g/cm3; 40,0% − 1,096 g/cm3.
Jeszcze raz bardzo proszę o rozwiązania tych zadań

Z góry serdecznie dziękuję
Gustlik: ad 7. W wodzie rozpuszczono 2,5 mola NaOH, uzyskując roztwór o stężeniu 0,500 mol/dm3. Oblicz
objętość uzyskanego roztworu.
Stęzenie molowe:
| | n | |
Cm= |
| , gdzie n − liczba moli rozpuszczonej substancji, Vr − objętość roztworu. |
| | Vr | |
Np. stężenie 0,500 mol/dm
3 oznacza, że na każdy 1 dm
3 przypada 0,5 mola NaOH.
C
m*V
r=n
Gustlik:
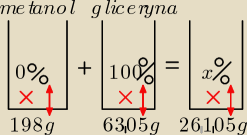
ad 4. Do 250 cm
3 alkoholu metylowego dodano 50 cm
3 gliceryny. Oblicz stężenie procentowe
gliceryny w alkoholu metylowym. Gęstość alkoholu metylowego − 0,792g/cm
3, gliceryny −
1,261g/cm
3
Najpierw obliczymy masę metanolu i gliceryny.
Masa metanolu:
m
m=d
m*V
m=0,792*250=198 g
Masa gliceryny:
m
g=d
g*V
g=1,261*50=63,05 g
Teraz metoda kubełkowa:
Metanol jako rozpuszczalnik traktuję jak roztwór 0%, a glicerynę − jako roztwór 100 %.
198*0+63,05*100=261,05x
6305=261,05x /:261,05
x≈24,15 %
 Z góry serdecznie dziękuję
Z góry serdecznie dziękuję 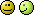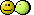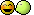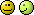
 Wskazówka: stężenia procentowe najlepiej liczyć metodą kubełkową.
ad 1. Do 240 g wody dodano 60g azotanu (V) amonu. Oblicz stężenie NH4NO3 w tym roztworze.
0*240+100*60=300x
6000=300x /:300
x=20 %
Wskazówka: stężenia procentowe najlepiej liczyć metodą kubełkową.
ad 1. Do 240 g wody dodano 60g azotanu (V) amonu. Oblicz stężenie NH4NO3 w tym roztworze.
0*240+100*60=300x
6000=300x /:300
x=20 %
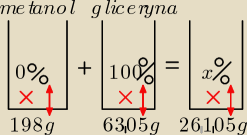 ad 4. Do 250 cm3 alkoholu metylowego dodano 50 cm3 gliceryny. Oblicz stężenie procentowe
gliceryny w alkoholu metylowym. Gęstość alkoholu metylowego − 0,792g/cm3, gliceryny −
1,261g/cm3
Najpierw obliczymy masę metanolu i gliceryny.
ad 4. Do 250 cm3 alkoholu metylowego dodano 50 cm3 gliceryny. Oblicz stężenie procentowe
gliceryny w alkoholu metylowym. Gęstość alkoholu metylowego − 0,792g/cm3, gliceryny −
1,261g/cm3
Najpierw obliczymy masę metanolu i gliceryny.
