chemia
POTRZEBUJACA POMOCY: Może jest tu ktoś,kto zna się na wiązaniach z chemii (zakres podstawowy) i mógłby
udzielic"internetowych korków"

Bylabym bardzo bardzo BARDZO wdzięczna

21 kwi 14:50
Alkain: Zadawaj pytania coś na pewno pomogę

21 kwi 14:56
POTRZEBUJACA POMOCY: Ustal rodzaje wiazan a nastepnienarysuj wzory elektronowe: zwiazkow:
siarkowodór,bromowodór,tlenek litu,bromek potasu,czasteczka azotu. Nie wiem,jak ustalic jakie
to bedzie wiazanie.mozemy robic po kolei ,a ty bedziesz mi tlumaczyc?

to zacznijmy od
pierwszego.JUZ DZIEKUJE!
21 kwi 15:23
POTRZEBUJACA POMOCY: Ustal rodzaje wiazan a nastepnienarysuj wzory elektronowe: zwiazkow:
siarkowodór,bromowodór,tlenek litu,bromek potasu,czasteczka azotu. Nie wiem,jak ustalic jakie
to bedzie wiazanie.mozemy robic po kolei ,a ty bedziesz mi tlumaczyc?

to zacznijmy od
pierwszego.JUZ DZIEKUJE!
21 kwi 15:23
POTRZEBUJACA POMOCY: Ustal rodzaje wiazan a nastepnienarysuj wzory elektronowe: zwiazkow:
siarkowodór,bromowodór,tlenek litu,bromek potasu,czasteczka azotu. Nie wiem,jak ustalic jakie
to bedzie wiazanie.mozemy robic po kolei ,a ty bedziesz mi tlumaczyc?

to zacznijmy od
pierwszego.JUZ DZIEKUJE!
21 kwi 15:23
Alkain:
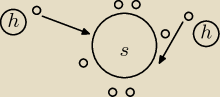
Zacznijmy od wytłumaczenia pewnego zagadnienia musisz wiedzieć co to jest skala
elektroujemności Paulinga. Ciężko określić co to dokładnie jest, ale określa to
elektroujemność danego pierwiastka czyli energię do stworzenia wiązania ?
I tak jeśli różnica energii pomiędzy dwoma pierwiastkami nie przekracza 0,4 mamy do czynienia z
wiązaniem kowalencyjnym niespolaryzowanym. Czyli wszystkie cząsteczki H
2, 0
2 itp.
Gdy energia wiązania przekracza 0,4 ale jest mniejsza od 1,9 mamy do czynienia z wiązaniem
kowalencyjnym spolaryzowanym np. HCl
Ostatnim typem jest wiązanie jonowe z energią powyżej 1,9 przykład NaCl
Dobra teraz jedziemy od 1

siarkowodór czyli H
2S
wodór ma elektroujemność 2,2 w skali Paulinga
siarka natomiast 2,58
Jak widać 2,58−2,2 da nam zaledwie 0,38 Czyli H
2S tworzy wiązanie kowalencyjne
niespolaryzowane.
Siarka ma 6 elektronów walencyjnych (patrz rysunek) w ułożeniu jak na rysunku wodór ma tylko po
1 walencyjnym dlatego się przyłączają.
Uff dobra starałem się też opisać to tak żebyś zrozumiała spróbuj 2 zrobić i zadawaj pytania z
tego co nie wiesz

21 kwi 15:53
Alkain: Coś zobaczyłem według karty wzorów maturalnych różnica elektroujemności wychodzi 0,4 więc
będzie to już spolaryzowane ale słabo.
I jeszcze jedno miałem napisać, w wiązaniu kowalencyjnym te elektrony walencyjne się
uwspólniają, natomiast w wiązaniu jonowym pierwiastek bardziej elektroujemny po prostu sobie
zabiera ten elektron

21 kwi 16:00
POTRZEBUJACA POMOCY:
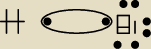
No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?

21 kwi 16:01
POTRZEBUJACA POMOCY:

No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?

21 kwi 16:01
Mateusz:
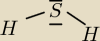
siarkowodór ma wzór H
2S no nie patrzymy do tablicy elektroujemnosci wg Paulinga odczytujemy ze
elektroujemnosc siarki wynosi: 2,6 a wodoru:2,1
teraz liczymy roznice elektroujemnosci
ΔE= 2,6−2,1=0,4 => wiązanie kowalencyjne spolaryzowane
Centralnie rysujemy atom siarki a po jego lewej i prawej stronie po jednym atomie wodoru z
jednym elektronem walencyjnym aby uzyskac dublet potrzebuje on drugiego elektronu a więc
utworzy jedną wspólną parę elektronowa z elektronem pochodzącym od atomu siarki( dlatego od
strony atomów wodoru rysujemy przy sioarce po jednym elektronie pozostałe cztery rozmieszczamy
wokół parami ) w sumie powstaną nam dwie pary elektronowe są one przesunięte w strone atomu
siarki(większa elektroujemnosc)
kolejne robisz podobnie okreslasz roznice elektroujemnosci i na podstawie tego okreslasz jakie
wiązanie i kreslisz mechanizm jedynie w przypadku tlenku litu występuje zawsze wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,sole metali aktywnych(litowce,berylowce−bez berylu).
21 kwi 16:01
Mateusz:
tak dokładnie

tak ma byc
21 kwi 16:03
POTRZEBUJACA POMOCY: No dobra,jak juz wiem ze jakies jest kowalencyjne(spolaryzowane albo nie),jonowe lub
koordynacyjne to co mi to daje...?
21 kwi 16:04
Alkain: HBr dobrze zrobiony

możesz robić kreski tak jak to zrobił
Mateusz nie muszą być kropki
i te wspólne zakreślanie tych elektronów

21 kwi 16:06
Alkain: Potrzebująca daje Ci to wiedzę jak zrobić zadanie

Po prostu to są takie typy wiązań, w zadaniu masz je określić, aby to zrobić liczysz właśnie
różnicę elektroujemność a następnie robisz odpowiedni rysunek i gotowe

21 kwi 16:09
POTRZEBUJACA POMOCY:

tlenek litu−jonowe(bo to tlenek )

Li
2O
kurde nie umiem tu rysowac.

21 kwi 16:10
POTRZEBUJACA POMOCY: bromek potasu ma wzor :KBr?

21 kwi 16:12
Mateusz:
No jonowego to tu nie musisz przedstawiac graficznie

no jedynie przegrupowanie elektronów
mozna by przedstawic co poniekąd przedstawiłaś
21 kwi 16:12
Mateusz:
tak

21 kwi 16:12
POTRZEBUJACA POMOCY:
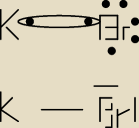
2,8 − 0,9=1,9 kowalencyjne spolaryzowane
nie wiem jak kreskowy

21 kwi 16:18
Mateusz:
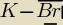
zabrakło jednego elektronu przy Br

21 kwi 16:22
Alkain: To już będzie wiązanie jonowe
. Problemem jest to że różne książki różnie podają od ilu jest wiązanie i elektroujemności.
21 kwi 16:23
POTRZEBUJACA POMOCY: dlaczego jonowe?
21 kwi 16:24
Mateusz:
a faktycznie nie zauwazyłem nawet ze mamy wiązanie jonowe

21 kwi 16:25
Mateusz:
bo ΔE>1,7 poza tym prosze czytac moje posty

wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,
sole metali aktywnych(litowce,berylowce−bez berylu).
21 kwi 16:26
POTRZEBUJACA POMOCY: ej powoli

jedna kreseczka przestawia dwa elektrony.brom mial 6.jeden poszedl sobie do potasu,zostaly dwie
wolne pary i jeden elektron ,dlaczego ten 1 elektron ma byc nagle kreską?
21 kwi 16:27
Mateusz:
KBr jest właśnie solą ktora spełnia te warunki jest solą metalu aktywnego nalezącego do grupy
litowców
21 kwi 16:27
POTRZEBUJACA POMOCY: "tlenek litu−jonowe(bo to tlenek )

" czytam uwaznie !

21 kwi 16:28
Mateusz:
a ile brom ma elektronów walencyjnych

?
21 kwi 16:29
Mateusz:
tyle ze to juz czysto teoretyczne dywagacje bo bromek potasu ma wiązanie jonowe wiec nie ma
sensu przedstawiac go jako związek kowalencyjny spolaryzowany
21 kwi 16:30
POTRZEBUJACA POMOCY: 7,ok zgadza sie

moj blad
21 kwi 16:30
POTRZEBUJACA POMOCY: A jak mam tak: ustal rodzaje wiazan :amoniak
21 kwi 16:32
Jadwiga: wykaż, że jeżeli x=5cosα i y=3sinα, to 9x2+25y2=225
21 kwi 16:34
POTRZEBUJACA POMOCY:
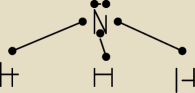
NH
3
21 kwi 16:36
Mateusz:
wiązanie donorowo−akceptorowe miałaś

?
21 kwi 16:36
POTRZEBUJACA POMOCY: jak policzyc roznice elektroujemnosci?mnozyc elektroujemnosc h razy 3?
21 kwi 16:37
POTRZEBUJACA POMOCY: hmmm...no wlasnie mialam,ale ja tego kompletnie nie ogarniam...
21 kwi 16:38
POTRZEBUJACA POMOCY: kiedy sa te wiazania koordynacyjne?bo to chyba takie bedzie ?
21 kwi 16:39
Mateusz: cofam pytanie pomyliłem sobie z jonem amonowym a to nie to samo

dobra delta E= 0,9 a więc
wiązanie kowalencyjne spolaryzowane
atom azotu do utworzenia wiązan z atomem wodoru wykorzystał juz trzy z pięciu elektronów
walencyjnych dwa pozostałe stanowią kolejną pare elektronowa−(ktora własnie moze byc
wykorzystana do utworzenia np jonu amonowego czyli przyłączenia dodatkowego H
+) => cząsteczka
ma kształ takiej piramidki trygonalnej
21 kwi 16:41
Mateusz:
koordynacyjnego na podstawach raczej nie będzie to takie specyficzne wiązanie mozna powiedziec
szczegolny przypadek wiazania kowalencyjego ale nie ma co sobie nim na razie zaprzątac głowy

21 kwi 16:44
POTRZEBUJACA POMOCY: Niestety w moje szkole a konkretniej na mojej chemii bedzie .nie wiem po co,ale bedzie.
ale skupmy sie narazie na kowalencyjnym i jonowym.a potem najwyzej tamto...
21 kwi 16:49
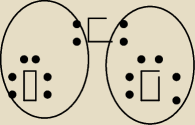
POTRZEBUJACA POMOCY: a jak mam CO2 ?
21 kwi 16:50
POTRZEBUJACA POMOCY:
21 kwi 16:54
POTRZEBUJACA POMOCY: jak patrze do zeszytu to mam jakeis pogrubiane strzalki czy cos.jak stwierdzic jakie to
wiazanie jak mam dwa tleny?
21 kwi 16:56
Mateusz:
No to musimy sobie zaprzątnąć głowe

chcoiaz nie musimy bo CO
2 ma wiązania kowalencyjne tak
naprawde a ze jest jedno koordynacyjne bo CO posiada dwa czyli jedną wolną pare elektronową
konkretnie atom tlenu no to moze byc dawcą czyli donorem a drugi at tlenu akceptorem tej
parki

i tak powstaje nam CO
2
21 kwi 16:57
POTRZEBUJACA POMOCY: mozesz mi to narysowac?
21 kwi 16:59
POTRZEBUJACA POMOCY: NIE rozumiem tego chyba,nie wiem jak to rozponac

21 kwi 17:00
Mateusz:
donorem jest at węgla nie tlenu ale sie chochliki wkradają

21 kwi 17:04
POTRZEBUJACA POMOCY: jeszcze jedno pytanie

kiedy sa normalne kreski,a kiedy te pogrubiane i jak to rozpoznac,ze
mam dac taka a nie innaa?
21 kwi 17:05
POTRZEBUJACA POMOCY: narysuj mi to "Coś"

21 kwi 17:06
Mateusz:
Tak jak mowie to specyficzny rodzaj wiązania nie występuje tak często (przynajmniej w przypadku
chemii licealnej) wystarczy ze wiesz jaka jest jego idea i wymienisz przykładowe związki w
ktorych ono występuje

21 kwi 17:06
Mateusz:

chodzi ci o strzałke?
21 kwi 17:07
POTRZEBUJACA POMOCY: No dobra,a H2O ? jak to zrobic?jak rozumowac?
21 kwi 17:08
POTRZEBUJACA POMOCY:
nie...ta strzalka jest w koordynacyjnych chyba,a mi chodzi o to:
21 kwi 17:09
POTRZEBUJACA POMOCY: to bedzie kowalencyjne spolaryzowane bo roznica elektroujemnosci=1,4

21 kwi 17:10
POTRZEBUJACA POMOCY: to bedzie kowalencyjne spolaryzowane bo roznica elektroujemnosci=1,4

21 kwi 17:10
Mateusz:

takim klinem wskazujesz kierunek polaryzacji w wiązaniach kowalencyjnych spolaryzowanych np jak
na rysunkull
21 kwi 17:13
POTRZEBUJACA POMOCY:
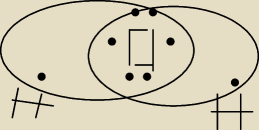
tak?
21 kwi 17:13
Mateusz:
tak
21 kwi 17:13
POTRZEBUJACA POMOCY: czyli ten klin wystepuje TYLKO w wiazaniach kowalencyjnych spolaryzowanych?
21 kwi 17:13
Mateusz:
zazwyczaj

21 kwi 17:14
POTRZEBUJACA POMOCY:
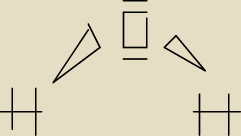
tak to ma wyglada w przypadku H
2O?
21 kwi 17:15
Mateusz:
tak tyle ze kliny skierowane do atomu tlenu bo jest bardziej elektroujemny niz wodór
21 kwi 17:16
POTRZEBUJACA POMOCY: to są skierowane,mowilam,ze nie umiem rysowac w tym programie

no to dobra,to rozumiem...

a
jak mam tlenek glinu?to bedzie oczywiscie jonowe bo to tlenek ,,,
21 kwi 17:18
POTRZEBUJACA POMOCY: Al
2O
3
jak to narysowac

21 kwi 17:20
Mateusz:
nie nie chodzi o te czubki klinów one muszą byc do tlenu

nie tak jak narysowałas

ale
mniejsza o to
21 kwi 17:20
POTRZEBUJACA POMOCY: ale klin ma byc chyba grubszy tam gdzie ejst pierwiastek o wiekszej elektroujemnosci...jestes
pewny,ze to jest zle?
21 kwi 17:22
Mateusz:
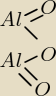
glin jest trzywartosciowy a tlen dwuwartościowy
21 kwi 17:23
Mateusz:
Masz racje znowu wpadka

21 kwi 17:24
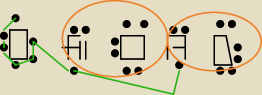
POTRZEBUJACA POMOCY:
21 kwi 17:26
POTRZEBUJACA POMOCY: hahahah,co za estetyka

brawo dla mnie,ale ogolnie to moze tak byc?

21 kwi 17:27
Mateusz:


moze lepiej zrob tak jak ja
21 kwi 17:29
POTRZEBUJACA POMOCY: mozesz mi narysowac kropkowy tak ladnie?
21 kwi 17:29
Mateusz: sama mozesz to zrobić

dwie kropki to jedna kreska patrzysz na moje i rysujesz same kropki
nie łącząc ich kreskami
21 kwi 17:30
POTRZEBUJACA POMOCY:
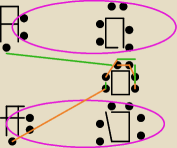
tak ?

21 kwi 17:36
POTRZEBUJACA POMOCY: jak mam HNO
2 ,to jakie to bedzie wiazanie i jak to sprawdzasz?

21 kwi 17:39
21 kwi 17:43
POTRZEBUJACA POMOCY: nie rozumiem.tlen ma 6 elektronow a glin 3 przeciez ..

21 kwi 17:45
Mateusz:
ale ja rysuje juz bez tych pozostałych elektronów

21 kwi 17:46
POTRZEBUJACA POMOCY: no dobra,mniejsza z tym.a to HNO
2 ? jak to zrobic?

21 kwi 17:47
POTRZEBUJACA POMOCY: Jest tam ktoś ? : >
21 kwi 18:06
Mateusz:
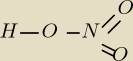
wiązania kowalencyjne mozesz okreslic dla kazdego układu osobna np dla H−O−N i
O=N=O
21 kwi 18:22
POTRZEBUJACA POMOCY: a jak mam NH4Cl?jaka jest kolejnosc jak podchodzisz do takich zadan?
21 kwi 18:27
 Bylabym bardzo bardzo BARDZO wdzięczna
Bylabym bardzo bardzo BARDZO wdzięczna 

 to zacznijmy od
pierwszego.JUZ DZIEKUJE!
to zacznijmy od
pierwszego.JUZ DZIEKUJE!
 to zacznijmy od
pierwszego.JUZ DZIEKUJE!
to zacznijmy od
pierwszego.JUZ DZIEKUJE!
 to zacznijmy od
pierwszego.JUZ DZIEKUJE!
to zacznijmy od
pierwszego.JUZ DZIEKUJE!
 Zacznijmy od wytłumaczenia pewnego zagadnienia musisz wiedzieć co to jest skala
elektroujemności Paulinga. Ciężko określić co to dokładnie jest, ale określa to
elektroujemność danego pierwiastka czyli energię do stworzenia wiązania ?
I tak jeśli różnica energii pomiędzy dwoma pierwiastkami nie przekracza 0,4 mamy do czynienia z
wiązaniem kowalencyjnym niespolaryzowanym. Czyli wszystkie cząsteczki H2, 02 itp.
Gdy energia wiązania przekracza 0,4 ale jest mniejsza od 1,9 mamy do czynienia z wiązaniem
kowalencyjnym spolaryzowanym np. HCl
Ostatnim typem jest wiązanie jonowe z energią powyżej 1,9 przykład NaCl
Dobra teraz jedziemy od 1
Zacznijmy od wytłumaczenia pewnego zagadnienia musisz wiedzieć co to jest skala
elektroujemności Paulinga. Ciężko określić co to dokładnie jest, ale określa to
elektroujemność danego pierwiastka czyli energię do stworzenia wiązania ?
I tak jeśli różnica energii pomiędzy dwoma pierwiastkami nie przekracza 0,4 mamy do czynienia z
wiązaniem kowalencyjnym niespolaryzowanym. Czyli wszystkie cząsteczki H2, 02 itp.
Gdy energia wiązania przekracza 0,4 ale jest mniejsza od 1,9 mamy do czynienia z wiązaniem
kowalencyjnym spolaryzowanym np. HCl
Ostatnim typem jest wiązanie jonowe z energią powyżej 1,9 przykład NaCl
Dobra teraz jedziemy od 1  siarkowodór czyli H2S
wodór ma elektroujemność 2,2 w skali Paulinga
siarka natomiast 2,58
Jak widać 2,58−2,2 da nam zaledwie 0,38 Czyli H2S tworzy wiązanie kowalencyjne
niespolaryzowane.
Siarka ma 6 elektronów walencyjnych (patrz rysunek) w ułożeniu jak na rysunku wodór ma tylko po
1 walencyjnym dlatego się przyłączają.
Uff dobra starałem się też opisać to tak żebyś zrozumiała spróbuj 2 zrobić i zadawaj pytania z
tego co nie wiesz
siarkowodór czyli H2S
wodór ma elektroujemność 2,2 w skali Paulinga
siarka natomiast 2,58
Jak widać 2,58−2,2 da nam zaledwie 0,38 Czyli H2S tworzy wiązanie kowalencyjne
niespolaryzowane.
Siarka ma 6 elektronów walencyjnych (patrz rysunek) w ułożeniu jak na rysunku wodór ma tylko po
1 walencyjnym dlatego się przyłączają.
Uff dobra starałem się też opisać to tak żebyś zrozumiała spróbuj 2 zrobić i zadawaj pytania z
tego co nie wiesz 

 No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?
No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?
 No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?
No ok,to w miare rozumiem. Mam np.HBr.
brom 2,8
H 2,1
2,8−2,1=0,7 wiec kowaencyjne spolaryzowane...
tak ma być?
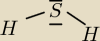 siarkowodór ma wzór H2S no nie patrzymy do tablicy elektroujemnosci wg Paulinga odczytujemy ze
elektroujemnosc siarki wynosi: 2,6 a wodoru:2,1
teraz liczymy roznice elektroujemnosci
ΔE= 2,6−2,1=0,4 => wiązanie kowalencyjne spolaryzowane
Centralnie rysujemy atom siarki a po jego lewej i prawej stronie po jednym atomie wodoru z
jednym elektronem walencyjnym aby uzyskac dublet potrzebuje on drugiego elektronu a więc
utworzy jedną wspólną parę elektronowa z elektronem pochodzącym od atomu siarki( dlatego od
strony atomów wodoru rysujemy przy sioarce po jednym elektronie pozostałe cztery rozmieszczamy
wokół parami ) w sumie powstaną nam dwie pary elektronowe są one przesunięte w strone atomu
siarki(większa elektroujemnosc)
kolejne robisz podobnie okreslasz roznice elektroujemnosci i na podstawie tego okreslasz jakie
wiązanie i kreslisz mechanizm jedynie w przypadku tlenku litu występuje zawsze wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,sole metali aktywnych(litowce,berylowce−bez berylu).
siarkowodór ma wzór H2S no nie patrzymy do tablicy elektroujemnosci wg Paulinga odczytujemy ze
elektroujemnosc siarki wynosi: 2,6 a wodoru:2,1
teraz liczymy roznice elektroujemnosci
ΔE= 2,6−2,1=0,4 => wiązanie kowalencyjne spolaryzowane
Centralnie rysujemy atom siarki a po jego lewej i prawej stronie po jednym atomie wodoru z
jednym elektronem walencyjnym aby uzyskac dublet potrzebuje on drugiego elektronu a więc
utworzy jedną wspólną parę elektronowa z elektronem pochodzącym od atomu siarki( dlatego od
strony atomów wodoru rysujemy przy sioarce po jednym elektronie pozostałe cztery rozmieszczamy
wokół parami ) w sumie powstaną nam dwie pary elektronowe są one przesunięte w strone atomu
siarki(większa elektroujemnosc)
kolejne robisz podobnie okreslasz roznice elektroujemnosci i na podstawie tego okreslasz jakie
wiązanie i kreslisz mechanizm jedynie w przypadku tlenku litu występuje zawsze wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,sole metali aktywnych(litowce,berylowce−bez berylu).
 tak ma byc
tak ma byc
 możesz robić kreski tak jak to zrobił Mateusz nie muszą być kropki
i te wspólne zakreślanie tych elektronów
możesz robić kreski tak jak to zrobił Mateusz nie muszą być kropki
i te wspólne zakreślanie tych elektronów 
 Po prostu to są takie typy wiązań, w zadaniu masz je określić, aby to zrobić liczysz właśnie
różnicę elektroujemność a następnie robisz odpowiedni rysunek i gotowe
Po prostu to są takie typy wiązań, w zadaniu masz je określić, aby to zrobić liczysz właśnie
różnicę elektroujemność a następnie robisz odpowiedni rysunek i gotowe 
 tlenek litu−jonowe(bo to tlenek )
tlenek litu−jonowe(bo to tlenek ) Li2O
kurde nie umiem tu rysowac.
Li2O
kurde nie umiem tu rysowac.

 no jedynie przegrupowanie elektronów
mozna by przedstawic co poniekąd przedstawiłaś
no jedynie przegrupowanie elektronów
mozna by przedstawic co poniekąd przedstawiłaś

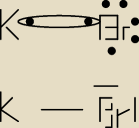 2,8 − 0,9=1,9 kowalencyjne spolaryzowane
nie wiem jak kreskowy
2,8 − 0,9=1,9 kowalencyjne spolaryzowane
nie wiem jak kreskowy 
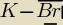 zabrakło jednego elektronu przy Br
zabrakło jednego elektronu przy Br 

 wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,sole metali aktywnych(litowce,berylowce−bez berylu).
wiązanie
jonowe bo wiązanie jonowe występuje bez względu na roznice ΔE w takich związkach:
tlenki,wodorki,wodorotlenki,sole metali aktywnych(litowce,berylowce−bez berylu).
 jedna kreseczka przestawia dwa elektrony.brom mial 6.jeden poszedl sobie do potasu,zostaly dwie
wolne pary i jeden elektron ,dlaczego ten 1 elektron ma byc nagle kreską?
jedna kreseczka przestawia dwa elektrony.brom mial 6.jeden poszedl sobie do potasu,zostaly dwie
wolne pary i jeden elektron ,dlaczego ten 1 elektron ma byc nagle kreską?
 " czytam uwaznie !
" czytam uwaznie ! 
 ?
?
 moj blad
moj blad
 NH3
NH3
 ?
?
 dobra delta E= 0,9 a więc
wiązanie kowalencyjne spolaryzowane
atom azotu do utworzenia wiązan z atomem wodoru wykorzystał juz trzy z pięciu elektronów
walencyjnych dwa pozostałe stanowią kolejną pare elektronowa−(ktora własnie moze byc
wykorzystana do utworzenia np jonu amonowego czyli przyłączenia dodatkowego H+) => cząsteczka
ma kształ takiej piramidki trygonalnej
dobra delta E= 0,9 a więc
wiązanie kowalencyjne spolaryzowane
atom azotu do utworzenia wiązan z atomem wodoru wykorzystał juz trzy z pięciu elektronów
walencyjnych dwa pozostałe stanowią kolejną pare elektronowa−(ktora własnie moze byc
wykorzystana do utworzenia np jonu amonowego czyli przyłączenia dodatkowego H+) => cząsteczka
ma kształ takiej piramidki trygonalnej


 chcoiaz nie musimy bo CO2 ma wiązania kowalencyjne tak
naprawde a ze jest jedno koordynacyjne bo CO posiada dwa czyli jedną wolną pare elektronową
konkretnie atom tlenu no to moze byc dawcą czyli donorem a drugi at tlenu akceptorem tej
parki
chcoiaz nie musimy bo CO2 ma wiązania kowalencyjne tak
naprawde a ze jest jedno koordynacyjne bo CO posiada dwa czyli jedną wolną pare elektronową
konkretnie atom tlenu no to moze byc dawcą czyli donorem a drugi at tlenu akceptorem tej
parki  i tak powstaje nam CO2
i tak powstaje nam CO2


 kiedy sa normalne kreski,a kiedy te pogrubiane i jak to rozpoznac,ze
mam dac taka a nie innaa?
kiedy sa normalne kreski,a kiedy te pogrubiane i jak to rozpoznac,ze
mam dac taka a nie innaa?


 chodzi ci o strzałke?
chodzi ci o strzałke?
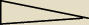 nie...ta strzalka jest w koordynacyjnych chyba,a mi chodzi o to:
nie...ta strzalka jest w koordynacyjnych chyba,a mi chodzi o to:


 takim klinem wskazujesz kierunek polaryzacji w wiązaniach kowalencyjnych spolaryzowanych np jak
na rysunkull
takim klinem wskazujesz kierunek polaryzacji w wiązaniach kowalencyjnych spolaryzowanych np jak
na rysunkull
 tak?
tak?

 tak to ma wyglada w przypadku H2O?
tak to ma wyglada w przypadku H2O?
 no to dobra,to rozumiem...
no to dobra,to rozumiem... a
jak mam tlenek glinu?to bedzie oczywiscie jonowe bo to tlenek ,,,
a
jak mam tlenek glinu?to bedzie oczywiscie jonowe bo to tlenek ,,,

 nie tak jak narysowałas
nie tak jak narysowałas  ale
mniejsza o to
ale
mniejsza o to
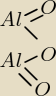 glin jest trzywartosciowy a tlen dwuwartościowy
glin jest trzywartosciowy a tlen dwuwartościowy


 brawo dla mnie,ale ogolnie to moze tak byc?
brawo dla mnie,ale ogolnie to moze tak byc? 

 moze lepiej zrob tak jak ja
moze lepiej zrob tak jak ja
 dwie kropki to jedna kreska patrzysz na moje i rysujesz same kropki
nie łącząc ich kreskami
dwie kropki to jedna kreska patrzysz na moje i rysujesz same kropki
nie łącząc ich kreskami
 tak ?
tak ?

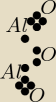 No ja bym to zrobił tak jak powyzej
No ja bym to zrobił tak jak powyzej 




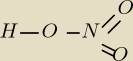 wiązania kowalencyjne mozesz okreslic dla kazdego układu osobna np dla H−O−N i
O=N=O
wiązania kowalencyjne mozesz okreslic dla kazdego układu osobna np dla H−O−N i
O=N=O